Advanced Science丨闵军霞团队发现锌离子在小肠组织的关键转运蛋白
近日,浙江大学转化医学研究院闵军霞教授/浙江大学医学院王福俤教授团队联合浙江大学医学院张岩教授团队在国际著名学术期刊Advanced Science(Q1, 14.4)在线发表了题为“The Intestinal Transporter SLC30A1 Plays a Critical Role in Regulating Systemic Zinc Homeostasis”的研究论文。

全文免费下载链接
http://doi.org/10.1002/advs.202406421
该研究利用多种基因编辑小鼠,通过系列体内外实验获得以下主要科学发现:
-阐明了肠道金属离子转运体SLC30A1 (ZnT1)在肠道上皮细胞的特殊定位是调控机体锌离子稳态的关键因素;
-揭示了肠道SLC30A1在维持正常的肠道屏障与功能中发挥着重要作用;
-利用冷冻电镜解析了SLC30A1的蛋白结构,构建了SLC30A1转运锌离子的途径模式,并证实了His43残基是SLC30A1选择性转运锌离子的关键位点。

论文首页截图
锌离子是机体第二大必需微量元素,人体基因组中大约10%的基因编码表达锌离子结合蛋白;这些宏量的蛋白质广泛参与机体的多种生理过程,因此锌离子稳态对维持机体健康十分重要。目前已发现多类蛋白家族参与锌离子稳态的调控,其中锌离子在细胞内外与细胞器中的分布主要受两类金属离子转运体家族的调控:一类为SLC30A(又称ZnT)家族,主要负责将细胞基质中的锌离子转运至细胞器内或外排至细胞膜外;另一类为SLC39A(又称ZIP)家族,则行使将细胞器或细胞膜外的锌离子转运至细胞基质中。这些锌离子转运体在细胞膜或细胞器膜上的不同定位赋予了它们在锌离子稳态调控中的特殊功能,与多种疾病息息相关。1995年人类第一次克隆发现了SLC30A1基因,并在随后的时间里利用体外细胞实验证实了它在细胞膜上广泛表达,在锌离子外排中发挥重要作用。直到2004年,研究人员首次利用基因编辑技术发现Slc30a1的全身缺失导致小鼠胚胎死亡,揭示了它在胚胎发育过程中不可或缺的功能。然而,正是由于这一特性,SLC30A1在不同组织中的特异性功能未能得到进一步探索。而近年来,SLC30A1蛋白功能的异常被发现可能与多种肿瘤与疾病的发生发展具有关联,因此靶向SLC30A1或具有重要的治疗意义。
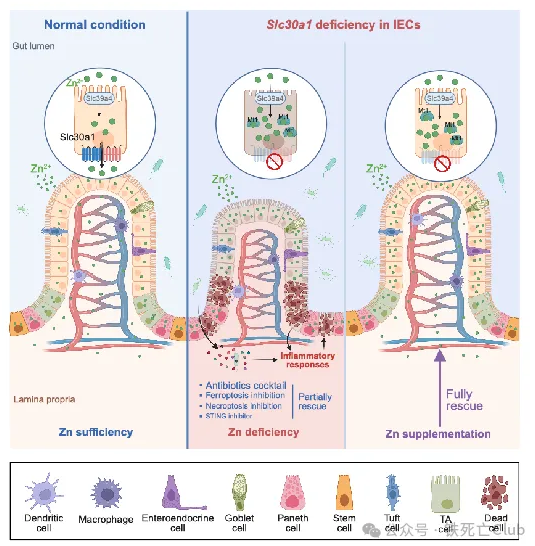
为了解决上述问题,该研究首次构建了全身性诱导敲除Slc30a1基因的小鼠,发现该小鼠在Slc30a1基因被诱导敲除的短期内便会死亡,同时表现为肠道和肝脏组织的严重损伤,提示Slc30a1在肠道和肝脏中可能发挥着重要的组织特异性功能。随后,该研究分别构建了Slc30a1在肠道和肝脏特异性表达缺失的小鼠,发现肝脏Slc30a1的小鼠可以生存,而肠道Slc30a1缺失的小鼠则胚胎致死,与全身性Slc30a1敲除小鼠具有类似的现象,这也是首次研究发现Slc30a1在肠道中的特异性的重要功能。为了进一步探索肠道Slc30a1发挥重要作用的相关分子机制,研究人员构建了诱导性肠道上皮细胞Slc30a1基因敲除的小鼠,发现该成年小鼠在Slc30a1诱导敲除后的短期内也会发生死亡,再一次证实了肠道Slc30a1对小鼠的生存具有关键作用。研究发现肠道Slc30a1的功能丧失在短时间内引起小鼠体内的器官损伤和免疫炎性反应是导致小鼠死亡的一个重要原因。
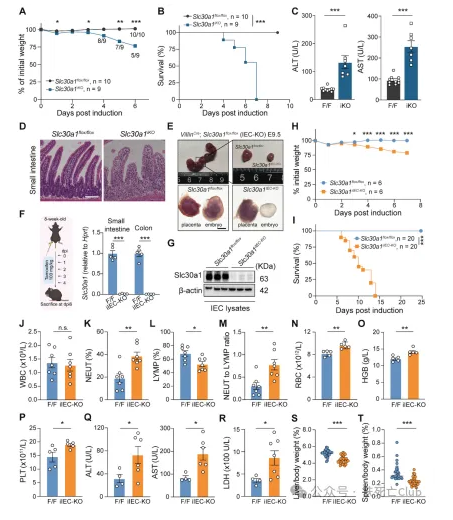
研究人员发现,肠道上皮细胞Slc30a1的缺失引起肠道本身组织结构严重损伤,屏障功能受损。在对肠道各类型细胞的分型探讨中发现,干细胞标志基因Lgr5的表达在肠道Slc30a1缺失的小鼠中显著下调。肠道干细胞主要集中在肠道微观结构单位的隐窝区域(Crypt),而在Slc30a1缺失的肠道中,隐窝区域积聚了大量死亡细胞,提示了干细胞标志物表达下降可能是由于肠道干细胞的大量死亡导致的。
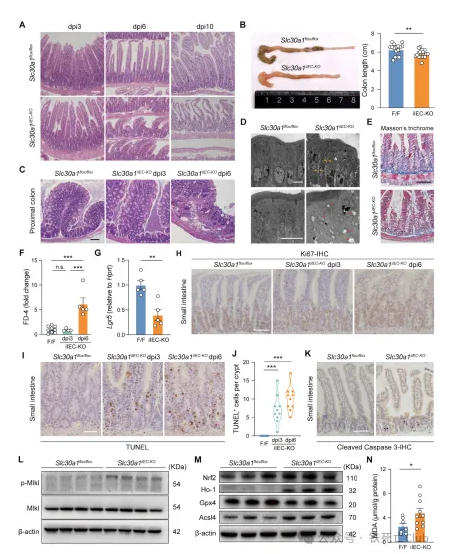
接下来,为了分析肠道Slc30a1缺失导致隐窝区域细胞大量死亡的机制,研究人员对Slc30a1缺失的肠道细胞进行了转录组测序,结果发现炎症反应通路被大量激活。而检测了小鼠血清中相关指标后发现,肠道Slc30a1缺失的小鼠中多种促炎细胞因子含量显著上升,并且血清中可检测出内毒素含量,提示过度的免疫炎症反应与肠道屏障破坏相关。深入分析发现,隐窝部分肠道细胞中发生显著表达变化的基因主要富集于I型干扰素的表达与下游信号通路中。通过对多条产生I型干扰素的先天免疫通路的蛋白表达检测分析发现,cGAS-STING信号通路的上调是导致肠道Slc30a1缺失小鼠中I型干扰素表达增多的主要原因;用该通路抑制剂H-151处理,可以显著延长肠道Slc30a1缺失小鼠的生存时间。另外,该研究结果表明,利用抗生素混合物抑制小鼠肠道菌群的生长增殖的同时减少先天免疫反应,也可显著延长肠道Slc30a1缺失小鼠的生存周期,并改善了该小鼠肠道组织结构的损伤,减少隐窝区域细胞的死亡。然而,抗生素处理并不能逆转干细胞标志基因Lgr5的表达,提示了过激的免疫炎症反应是加速肠道细胞死亡的辅助因素,而不是根本因素。
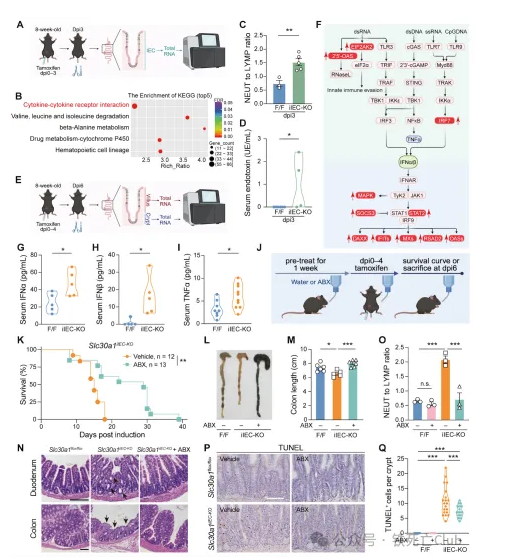
SLC30A1是经典的金属离子转运体,因此为了探究肠道隐窝上皮细胞死亡以及过度激活的免疫反应的根本原因,研究人员分析了敲除小鼠体内的金属离子稳态变化。利用ICP-MS对小鼠全身的多器官组织进行检测发现,敲除小鼠血清及肝脏中锌离子含量显著减少的同时,肠道上皮细胞中锌离子则显著蓄积;结合SLC30A1的锌离子外排功能,研究人员推测SLC30A1在肠道上皮细胞基底膜侧的定位是导致该现象发生的原因。因此,研究人员构建了Slc30a1蛋白示踪小鼠,检测了该小鼠肠道组织中Slc30a1的蛋白定位,并利用类器官技术在体外进一步验证,证实了Slc30a1蛋白在肠道上皮细胞基底膜侧的特殊定位。接下来,通过体外类器官实验,研究人员发现用锌离子螯合剂TPEN处理后肠道上皮细胞仍出现大量死亡,提示锌离子的蓄积可能不是导致细胞死亡的关键原因。因此,研究人员推测是否是血清中的锌离子减少导致敲除小鼠的多项表型。研究人员通过腹腔注射给予敲除小鼠体内补充适量锌离子,发现几乎所有表型都可被挽救。研究人员认为,肠道隐窝干细胞区域的锌离子来源主要吸收自血清中,与肠道上皮吸收细胞直接从肠腔吸收不同;而干细胞进行增殖分化的过程中,对锌离子的需求较大,而敲除小鼠中血清锌离子无法得到及时补充可能是干细胞区域细胞死亡的主要原因。
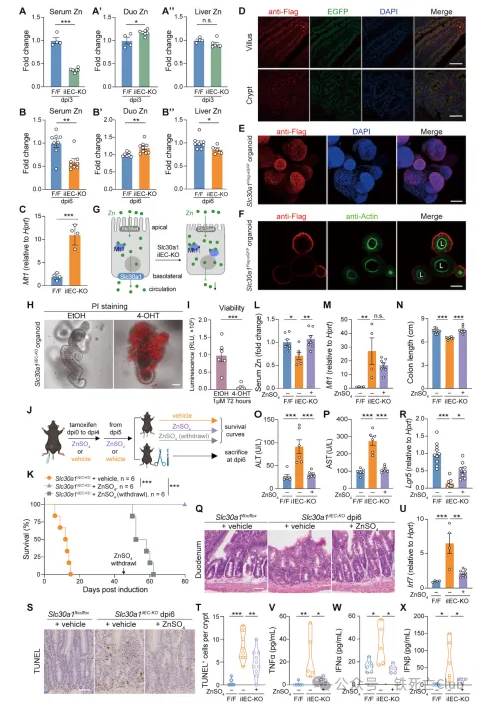
SLC30A1蛋白在脊椎动物中高度保守,为了阐明SLC30A1蛋白转运锌离子的分子模式,研究人员解析了人类SLC30A1蛋白的冷冻电镜结构。该蛋白为6次跨膜结构,生理情况下在细胞膜上形成紧密的同源二聚体发挥离子转运功能。研究人员通过构建一系列SLC30A1突变体,并通过细胞实验解析了蛋白结构中对锌离子转运较为重要的氨基酸位点,以及多个对蛋白结构稳定发挥重要功能的位点,提出了SLC30A1转运锌离子的途径模式图并验证了His43位点是该蛋白特异性转运锌离子的关键位点。

综上,该研究阐明了肠道SLC30A1在调控机体锌离子稳态中的关键作用,证实了该蛋白在肠道上皮细胞基底膜侧的特殊定位是其必需生理功能发挥的基础,从蛋白结构角度提出了SLC30A1转运锌离子的选择性及途径模式。该研究成果可为研究病理条件下的SLC30A1功能提供理论基础,或可加速靶向SLC30A1治疗相关疾病策略的开发。
研究成果模式图
浙江大学医学院博士后孙淑敏、博士研究生谢恩军、博士后徐杉、博士研究生戢素玉为该论文的共同第一作者。
闵军霞教授、王福俤教授、张岩教授(浙江大学)为共同通讯作者。该研究得到国家自然科学基金委项目资助。
参考文献
Shumin Sun (孙淑敏)#, Enjun Xie(谢恩军)#, Shan Xu(徐杉)#, Suyu Ji(戢素玉)#, Shufen Wang, Jie Shen, Rong Wang, Xinyi Shen, Yunxing Su, Zijun Song, Xiaotian Wu, Jiahui Zhou, Zhaoxian Cai, Xiaopeng Li, Yan Zhang(张岩),* Junxia Min(闵军霞),* Fudi Wang(王福俤)*. The intestinal transporter SLC30A1 plays a critical role in regulating systemic zinc homeostasis, Advanced Science, 2024, Oct 18:e2406421. http://doi.org/10.1002/advs.202406421


